医用生物材料为何被看作“下一个千亿赛道”?
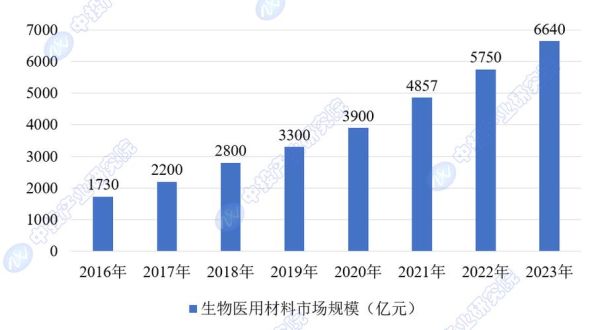
全球老龄化叠加慢性病高发,**植入器械与再生医学需求**正以每年两位数的速度增长。仅骨科耗材,中国年手术量就突破500万台,而现有金属、陶瓷材料在生物相容性、降解可控性上仍有痛点。生物材料通过**“材料+细胞+因子”**的三重协同,把传统“替代”升级为“再生”,打开了千亿级增量市场。
核心驱动因素:政策、资本与技术如何共振?
政策端:审批绿色通道缩短上市周期
- 国家药监局将**可降解镁合金骨钉**纳入创新医疗器械特别审查程序,Ⅲ类证平均审批时间从36个月压缩到14个月。
- “十四五”生物经济发展规划明确**高值生物材料国产化率2025年达70%**,直接带动地方政府设立专项基金。
资本端:一级市场单笔融资屡破纪录
2023年国内生物材料领域发生融资事件67起,**再生胶原支架企业B轮单笔金额达8亿元人民币**,背后站着红杉、高瓴等头部机构。资本看中的并非单品,而是**“平台型技术+多管线适应症”**的延展性。
技术端:三大突破让科幻场景落地
- **4D打印水凝胶**:温度触发形状记忆,实现微创植入后自动展开,心脏封堵器直径缩小60%。
- **基因激活生物玻璃**:释放特定离子调控成骨基因表达,骨缺损修复速度提升2.3倍。
- **异种脱细胞基质**:通过α-Gal抗原敲除猪小肠黏膜下层,制备神经导管,6周即可恢复大鼠90%运动功能。
哪些细分赛道最先跑出独角兽?
可吸收血管支架:替代金属的“最后一公里”
雅培Absorb的失败曾让行业降温,但**左旋聚乳酸(PLLA)改性技术**解决了径向支撑力不足的问题。国产Xinsorb的三年临床数据显示,靶血管失败率仅3.8%,显著低于金属支架的5.7%。**预计2026年市场规模突破120亿元**。
神经修复膜:从“不可再生”到“功能重建”
脊髓损伤年新增病例约12万,传统手术只能减压。清华大学团队研发的**定向纳米纤维壳聚糖膜**,通过拓扑结构引导轴突定向生长,配合BDNF缓释微球,使恒河猴后肢运动评分提高40%。**动物实验到人体试验仅耗时28个月**,刷新转化纪录。
生物墨水:器官打印的“芯片级”供应链
Cellink的胶原/藻酸盐混合墨水售价高达每毫升300美元,而国产**甲基丙烯酰化明胶(GelMA)**通过酶交联工艺将成本降至1/10。2024年杭州某医院完成**全球首例GelMA打印耳廓移植**,术后6个月软骨弹性模量接近天然组织。
商业化落地必须跨越的三道门槛
门槛一:临床验证如何设计“黄金终点”?
生物材料常与细胞、药物联用,传统“非劣效”评价可能掩盖真实疗效。**FDA最新指南建议采用“复合终点”**:既包含影像学骨愈合率,也纳入患者疼痛评分、二次手术率等真实世界指标。国内企业需提前布局**多中心、跨国队列**。

门槛二:规模化生产的“魔鬼细节”
以静电纺丝神经导管为例,**纤维直径从500nm降至200nm**时,细胞黏附效率提升50%,但产线良品率会从95%暴跌至60%。解决方案是引入**AI视觉实时监测+闭环张力控制**,实现纳米级精度下的连续生产。
门槛三:支付体系如何创新?
可吸收螺钉单颗定价8000元,是钛合金的4倍。上海医保局试点**“按疗效付费”**:若患者术后2年内无需二次取出,医保支付70%溢价;若需翻修,企业退还50%费用。该模式使**患者自费比例从62%降至28%**,企业毛利率仍保持55%以上。
未来五年最值得关注的三大变量
变量1:合成生物学重构材料基因库——通过工程化微生物生产重组人源胶原,纯度达99.9%,免疫原性接近自体组织。
变量2:AI逆向设计加速迭代——DeepMind的AlphaFold已能预测蛋白质-材料界面相互作用,将新型骨诱导肽发现周期从18个月缩短至72小时。
变量3:监管科学国际互认——中国加入IMDRF后,符合ISO/TS 10993-23标准的生物材料有望**一次测试,全球申报**,出口成本降低40%。

从业者该如何卡位?
对于初创企业,**“单点突破+专利围墙”**仍是王道:选择1-2个适应症做到极致,同步申请材料组成、制备工艺、临床使用方法等组合专利。对于传统器械巨头,**并购整合**更高效:威高2023年收购北京某壳聚糖初创企业,直接获得其**神经修复三类证+50项专利**,比自建管线节省3年时间。
投资人则需警惕**“伪创新”陷阱**:某些企业仅把PLA分子量微调就宣称“新一代可吸收材料”,但缺乏体内降解-力学性能-宿主反应的完整数据链。真正值得下注的标的,往往具备**“材料科学家+临床PI+法规事务专家”**的铁三角团队。

评论列表