医疗器械注册证代办流程:从立项到拿证需要多久?
很多初创企业一上来就问:“医疗器械注册证代办到底要跑多少部门?”答案并不简单,因为产品类别、临床需求、检测周期都会影响时间线。下面把常见路径拆解成四个阶段,方便你对照自家产品排期。
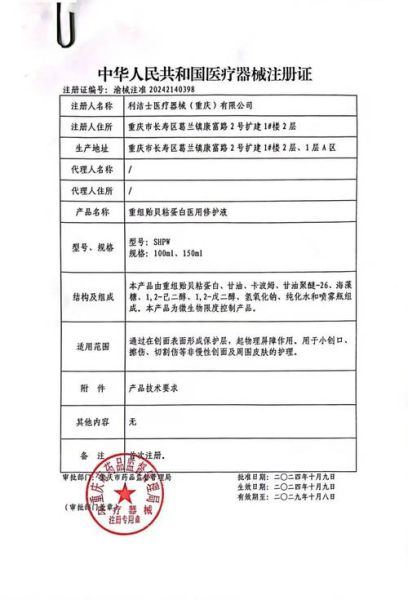
(图片来源网络,侵删)
阶段一:立项与分类界定
- 确认产品类别:Ⅰ类备案、Ⅱ类注册、Ⅲ类注册,三类监管强度逐级递增。
- 分类界定申请:向省药监局提交《分类界定申请表》,通常15个工作日给出书面回复。
- 建立GMP体系:Ⅱ类以上产品需先通过生产质量管理规范现场核查。
阶段二:注册检测与动物实验
“检测排队要多久?”这是企业最焦虑的环节。以有源器械为例:
- 型式检验:送样到国家级检测所,周期45~90天。
- EMC与安规:若涉及电气安全,需额外做GB 9706系列标准测试,排队时间再加20天。
- 动物实验:植入类产品必须做生物相容性,GLP实验室档期紧张,建议提前3个月预约。
阶段三:临床评价路径选择
企业常纠结:“豁免临床、同品种对比、临床试验,到底选哪条?”
- 豁免临床:国家局目录内产品可直接提交免临床资料,省局10个工作日完成形式审查。
- 同品种对比:需拿到对比产品授权书,并证明差异不影响安全有效性。
- 临床试验:Ⅲ类高风险产品几乎绕不开,单中心试验最快6个月,多中心12个月起步。
阶段四:注册申报与体系核查
资料一次性通过率不足40%,常见退审原因:
- 风险管理报告未覆盖全生命周期;
- 软件描述文档缺少网络安全章节;
- 生产地址与检验报告地址不一致。
省局技术审评60个工作日,Ⅲ类产品转国家局再延长60个工作日。体系核查与注册审评并行,现场检查0~10个缺陷项均属正常,整改后两周内完成复核。
医疗器械第三方检测费用:2024年最新价目表
“为什么同一台设备,不同机构报价差一倍?”关键在于资质、排期、附加服务。以下数据来自京津冀、长三角八家主流实验室的公开报价,供预算时参考。

(图片来源网络,侵删)
无源耗材类检测费用
| 项目 | 单价(元) | 备注 |
|---|---|---|
| 无菌检测 | 1,800 | 含方法学验证 |
| 细菌内毒素 | 1,200 | 凝胶法/光度法同价 |
| 包装密封性 | 3,500 | 染色液穿透法 |
| 加速老化 | 8,000 | 40℃/75%RH,12周 |
有源设备类检测费用
- 电气安全(GB 9706.1):25,000~35,000元,功率越大越贵。
- EMC全项(YY 0505):18,000~28,000元,若带无线模块需补做射频专项。
- 软件网络安全:15,000元起,按功能点计费。
- 可用性测试:30,000~50,000元,需招募20名临床用户。
动物实验与病理费用
植入实验通常选大动物:
- 骨植入兔模型:6,000元/只,含12周取材与病理切片。
- 皮下植入犬模型:12,000元/只,含血液生化、组织学评价。
- 急慢性毒性:按ISO 10993-11标准,全套报价80,000元起。
如何节省检测成本?
“有没有办法既省钱又不耽误拿证?”
- 打包议价:同一家机构做型式检验+EMC+动物实验,可谈下10%折扣。
- 共享对照品:与同行共用同品种对比产品的检测报告,分摊授权费。
- 预检摸底:先送样做内部预检,减少正式检测失败重测的风险。
代办机构与实验室选择避坑指南
看资质还是看速度?
“代办机构承诺三个月拿证,可信吗?”
- 查国家药监局备案:医疗器械注册人制度下,只有备案的CRO才能合法承接注册事务。
- 审合同条款:明确“因政策变化导致延期”的责任归属,避免无限期等待。
- 访实验室现场:设备校准证书、人员上岗证、样品流转记录缺一不可。
常见隐形收费
- 资料翻译按页计费,英文摘要每页300元;
- 补正资料快递费到付,单次200元起;
- 体系核查差旅实报实销,审核员往返机票可能上万。
把上述节点和费用全部纳入甘特图,你会发现Ⅱ类产品从立项到取证平均需要12~15个月,Ⅲ类产品18~24个月。提前半年启动,才是压缩成本、降低风险的王道。

(图片来源网络,侵删)

评论列表