一、医药行业面临的核心风险类型
在药品从实验室到患者手中的漫长链条里,任何环节都可能触发风险。以下五大类风险几乎覆盖了行业90%以上的“爆雷”场景:
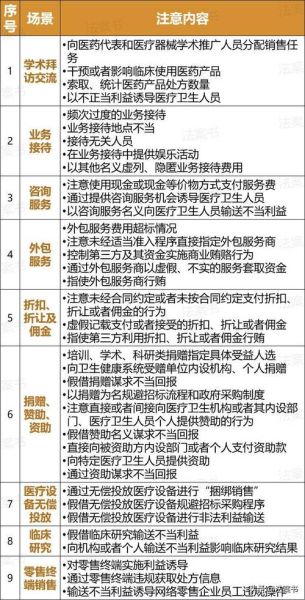
- 政策合规风险:集采降价、医保目录调整、GMP飞检、数据出境审查。
- 研发失败风险:Ⅲ期临床未达终点、罕见病适应症被FDA驳回、生物类似药专利诉讼。
- 供应链风险:关键起始物料断供、冷链温控失效、原料药垄断涨价。
- 商业化风险:上市即遭遇竞品降价、医院准入被拒、学术推广合规红线。
- 舆情与召回风险:不良反应事件发酵、黑框警告、全球批次召回。
二、政策合规:为何说“飞检”比“集采”更可怕?
很多从业者把集采降价视为头号压力,却忽视了GMP飞行检查的杀伤力。集采丢标只是利润变薄,飞检不合格则可能直接停产。
自问:飞检最常被查的三类缺陷是什么?
自答:
- 数据完整性:QC实验室未开启审计追踪、删除原始检验图谱。
- 交叉污染:高毒高活车间与普通制剂共用空调系统。
- 验证缺陷:培养基模拟灌装频次不足、灭菌柜再验证超期。
规避方法:建立“红黄线”预警表,把《药品生产质量管理规范》条款拆解为可量化的KPI,每月内部模拟飞检一次。
三、研发失败:从“临床设计”阶段就埋下隐患
Ⅲ期临床失败往往并非“运气差”,而是早期设计缺陷的延迟爆发。

自问:哪些设计失误最容易被监管机构“一票否决”?
自答:
- 终点选择错误:用替代终点(如PFS)申请加速审批,却拿不出OS获益。
- 入组标准过宽:纳入大量合并症患者,导致疗效信号被稀释。
- 统计假设激进:预设HR=0.5,实际仅0.78,样本量不足导致power<80%。
规避方法:在IND前召开“魔鬼代言人”会议,邀请外部统计学家和监管事务专家扮演FDA审查员,提前拆解方案漏洞。
四、供应链:原料药垄断如何引发“蝴蝶效应”?
2022年某抗生素因印度工厂环保关停,全球价格三个月暴涨300%,国内多家制剂企业被迫停产。
自问:如何判断一个原料药是否处于“高危险”垄断?

自答:
- 全球供应商≤3家,且CR3>80%。
- 合成路线涉及剧毒氰化物或高压加氢,环保审批壁垒高。
- 下游制剂市场规模>50亿元,需求弹性低。
规避方法:建立“双源+战略库存”模型,对符合上述三条的原料药提前锁定6-9个月安全库存,并签订不可抗力条款。
五、商业化:医院准入的“隐形门槛”
即使通过医保谈判,仍有30%的创新药在首年进院率低于10%。
自问:医院药事会真正关心的“非公开”指标是什么?
自答:
- 日均治疗费用是否低于现有方案20%以上。
- 不良反应处理成本:是否需新增血检、心电监护项目。
- 药学部工作量:是否需要建立TDM(治疗药物监测)流程。
规避方法:在Ⅲ期临床阶段就嵌入药物经济学研究,用真实世界数据证明“总成本更低”,而非单纯强调疗效。
六、舆情危机:24小时黄金沉默期如何操作?
某GLP-1减肥药在社交媒体爆出“甲状腺癌”病例后,企业股价当日跌停。
自问:舆情爆发第一夜,最忌讳的三种回应是什么?
自答:
- 否认一切:“无证据表明与药品相关”易激发公众逆反。
- 甩锅医生:“超适应症使用”会被视为推卸责任。
- 沉默拖延:超过6小时未发声,媒体会默认“默认”。
规避方法:提前准备“分级回应模板”,按不良反应严重程度分为A/B/C三级,每级对应不同话术和数据包,确保30分钟内可发布。
七、建立“风险雷达”:从被动救火到主动扫描
传统风险管理是“事件触发”,领先企业已转向“信号监测”。
自问:哪些非传统数据源能提前3-6个月预警风险?
自答:
- 专利诉讼数据库:监控竞争对手在主要市场的ANDA挑战。
- 海关进出口数据:发现原料药出口量异常下滑。
- 临床试验注册平台:竞品突然扩大适应症或修改终点。
- 医生社交平台:监测KOL对某疗法的负面讨论激增。
落地工具:用Python爬虫抓取上述数据源,建立“风险热度指数”,当指数突破阈值时自动触发跨部门会议。
八、尾声:把风险预算写进年度OKR
医药行业的风险无法消除,但可以“定价”。把潜在损失折算为财务预算,例如:
- 为Ⅲ期临床失败预留20%的沉没成本基金。
- 为原料药断供设置15%的涨价缓冲池。
- 为舆情危机准备年度营收的1%作为应急公关费。
当风险被量化后,决策层会更容易接受“花小钱买保险”而非“赌运气省成本”。

评论列表