囊性纤维化(Cystic Fibrosis,CF)是一种常染色体隐性遗传病,由CFTR基因突变导致氯离子通道功能障碍,进而引发多系统黏液堵塞。患者最常问的两个问题是:“囊性纤维化能治好吗?”以及“现在有哪些最新治疗进展?”下面分板块拆解。

(图片来源网络,侵删)
囊性纤维化到底能不能根治?
目前医学共识:囊性纤维化仍无法彻底根治,但已从“儿童期致命病”转变为“可控慢病”。
关键点:
- 平均生存期从上世纪60年代的10岁提升至40岁以上(欧美数据)。
- “治愈”定义正在变化:把肺功能长期维持在正常下限、减少住院次数,即视为临床治愈。
- 根治希望寄托于基因编辑+干细胞移植,尚处实验阶段。
CFTR调节剂:为什么说它是“靶向药物革命”?
传统治疗只能缓解症状,而CFTR调节剂直接修复蛋白功能,分三类:
- 增效剂(如Ivacaftor):适用于门控突变,服药后汗液氯离子浓度可下降50 mmol/L。
- 校正剂(如Lumacaftor、Tezacaftor):帮助F508del突变蛋白正确折叠。
- 放大剂(如Elexacaftor):提升蛋白表达量,三药组合(Trikafta)覆盖90%突变人群。
真实世界数据:使用Trikafta一年,FEV1平均提升10–14%,肺部急性加重减少63%。
基因疗法离临床还有多远?
问:基因疗法能否一次性解决所有突变?
答:目前分两条路线:
- 体外CRISPR:提取患者干细胞→体外编辑→回输,已在灵长类模型纠正F508del,预计2026年进入I期。
- 脂质纳米颗粒递送:直接向肺部递送CRISPR mRNA,跳过干细胞步骤,2023年启动早期试验。
挑战:脱靶风险、肺上皮细胞更新快导致疗效短暂。
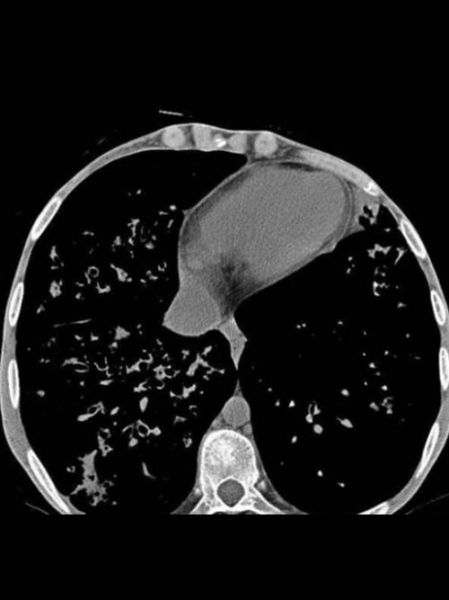
(图片来源网络,侵删)
抗感染策略升级:从“轮番轰炸”到“精准打击”
铜绿假单胞菌是CF患者肺衰竭主因。传统做法是长期吸入妥布霉素,但耐药率逐年攀升。
新武器:
- 吸入型噬菌体:英国Great Ormond Street医院2022年报告,12例耐药菌患者接受个体化噬菌体后,痰菌载量下降2–3 log10。
- 铁载体-抗生素偶联物(如Cefiderocol):利用细菌摄铁系统“特洛伊木马”式渗透,体外MIC值降低8倍。
营养与消化:胰腺外分泌不足的“隐藏杀手”
85% CF患者合并胰腺功能不全,脂溶性维生素缺乏导致骨质疏松、夜盲。
管理要点:
- 高剂量胰酶:每餐按脂肪克数计算,5000单位脂肪酶/克脂肪。
- 结构化脂质配方:中链甘油三酯(MCT)占60%,减少粪便能量丢失。
- 连续葡萄糖监测(CGM):早期发现CF相关糖尿病,HbA1c常滞后。
肺移植:最后底牌还是过渡方案?
过去认为移植是终末期唯一出路,如今观念更新:
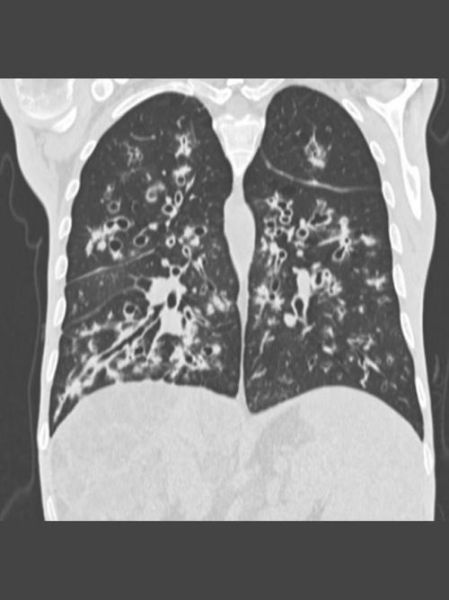
(图片来源网络,侵删)
- 指征放宽:FEV1<30%不再是绝对门槛,急性加重频繁亦可评估。
- 边缘供肺修复:使用EVLP(体外肺灌注)技术,将边缘肺利用率从15%提升到35%。
- 术后CFTR调节剂维持:移植后继续使用Trikafta,可延缓移植肺发生闭塞性细支气管炎。
患者日常管理:把医院搬回家
问:如何在家监测病情恶化?
答:三件套:
- 家用肺量计:每日测FEV1,下降≥10%预警。
- 汗液氯离子试纸:指尖血式设备,5分钟出结果,替代传统60元一次的实验室检测。
- 数字化振动背心:蓝牙连接手机,根据痰液黏度自动调节频率,比传统CPT省时30%。
未来展望:2025–2030年值得关注的里程碑
- 2025:CRISPR体内递送I期数据公布。
- 2026:下一代放大剂(VX-522)覆盖剩余10%罕见突变。
- 2027:首个可吸入mRNA疗法递交上市申请。
- 2030:基因编辑+干细胞联合方案有望使“功能性治愈”比例突破50%。
囊性纤维化正在经历从“治症”到“治病”再到“治根”的三级跳,患者与家庭需要做的,是与医生一起把每一天都当作临床试验,及时拥抱每一次技术迭代。

评论列表