行业现状:谁在领跑,谁在追赶?
2023年全球医疗器械市场规模已突破5800亿美元,中国以23.5%的年复合增长率成为增长最快的单一国家市场。 自问:国产替代真的完成了吗? 自答:高端影像、心脏起搏器、手术机器人三大赛道仍由美敦力、西门子、直觉外科占据七成以上份额,但微创、联影、东软正以“性价比+本地化服务”切入三级医院招标,份额从的12%升至28%。
政策风向:注册人制度带来哪些红利?
2021版《医疗器械监督管理条例》将注册人制度从试点推向全国,允许研发机构无需自建工厂即可持证。 自问:这对初创公司是馅饼还是陷阱? 自答: - **馅饼**:委托生产周期缩短4-6个月,前期投入下降30%-50%。 - **陷阱**:质量管理体系若外包,飞检不合格率上升至7.8%,远高于自建工厂的2.1%。
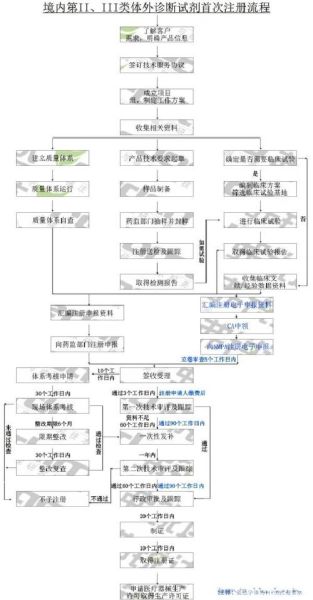
注册流程:一张图看懂七步关键节点
以第二类有源医疗器械为例,完整周期约10-14个月:
- 分类界定:向标管中心提交《分类界定申请表》,平均耗时20个工作日。
- 型式检验:送检至国家级检测所,样品量需满足1.5倍检验需求。
- 临床评价:可走同品种比对或临床试验,后者费用80-300万元不等。
- 注册申报:CMDE线上提交,技术资料需符合eRPS格式。
- 发补整改:平均1-2轮,每轮60个工作日内完成。
- 体系核查:药监局派2-3名审核员现场检查2-4天。
- 获批领证:制证周期10个工作日,有效期5年。
费用拆解:每一分钱花在哪儿?
自问:做一款家用血糖仪到底需要多少预算? 自答:
- 检测费:电磁兼容+安规6-8万元
- 临床费:100例受试者25-40万元
- 注册费:NMPA官方收费3.08万元
- 体系咨询:第三方辅导10-15万元
- 其他:翻译、公证、差旅5-10万元
合计:50-80万元即可拿证,远低于欧美15-20万美元的平均水平。
常见坑点:90%企业会踩的雷
1. 临床方案设计缺陷:对照组选择不当导致统计学差异不显著,需重新入组。 2. 标签说明书违规:未按《医疗器械标签管理规定》标注禁忌症,被责令召回。 3. 生产地址变更:未及时做许可事项变更,抽检被判为无证生产。 4. 软件更新:APP新增远程监测功能未走变更注册,遭行政处罚。

未来三年:哪些赛道值得All in?
自问:集采杀价下还有高毛利空间吗? 自答:避开冠脉支架、骨科关节等红海领域,关注:
- 神经介入取栓支架:国产化率不足15%,单价2-3万元。
- 人工心脏瓣膜:TAVR手术量年增50%,医保支付比例提升至70%。
- AI辅助诊断软件:三类证审批通道缩短至8个月,收费模式从一次性转向按次付费。
出海攻略:如何三个月拿下CE MDR?
1. 欧代选择:优先德国、荷兰机构,审核效率比南欧高40%。 2. 临床数据互认:利用中国多中心临床试验数据,通过SRN系统提交。 3. UDI实施:提前在EUDAMED注册,避免货物到港后无法清关。 4. 技术文档:按MDR附录II+III编制,比旧指令多风险管理章节。
实战案例:从0到1的10个月记录
某深圳初创公司脉搏血氧仪项目时间线: - 第1月:完成专利布局(发明+外观+实用新型) - 第2-3月:送检广东省医械所,整改EMC辐射发射超标问题 - 第4-6月:在湘雅医院完成120例临床试验 - 第7月:提交注册资料,收到一次性补正通知 - 第8-9月:通过GMP体系核查,零缺陷通过 - 第10月:获湘械注准批文,当月签下2000台医院采购订单
```

评论列表