医疗器械行业风险全景扫描
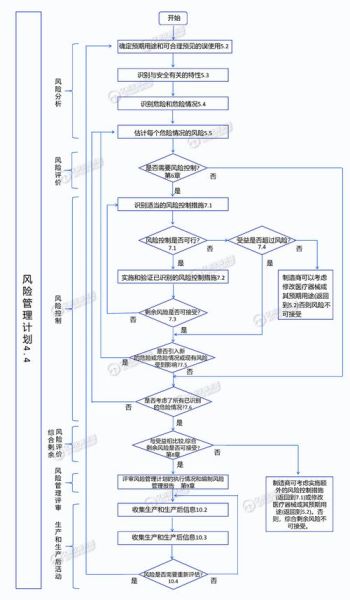
在医疗器械行业,风险从来不是单一维度。从产品研发到上市流通,再到临床使用,每一个环节都可能触发合规、质量、市场或财务层面的连锁反应。下面先用一张“风险地图”把关键节点串起来,再逐层拆解。

1. 法规更新滞后带来的合规风险
问:为什么法规更新会让企业措手不及?
答:因为注册路径、分类目录、临床评价要求随时可能调整,而企业往往在旧版体系里投入了大量资源,一旦新规落地,原有数据包可能直接作废。
2. 临床试验数据真实性质疑
问:哪些信号最容易被监管抽查盯上?
答:病例脱落率异常低、随访时间点过于整齐、统计学差异过于完美,都会触发飞行检查。2023年国家局通报的12起数据造假案中,有9起源于上述“异常信号”。
3. 供应链断链与原材料合规
问:进口原材料突然断供怎么办?
答:提前建立双源或多源备份,并对替代材料进行变更备案。注意,哪怕是同一供应商的不同批次,也要重新做生物相容性验证。
如何规避医疗器械合规风险:七步闭环法
Step 1 建立法规雷达系统
- 订阅NMPA、FDA、EMA的RSS更新
- 每季度做一次法规差异矩阵,把三国要求并排对比
- 用红色标签标出可能影响现有产品的条款
Step 2 设计变更的“最小可行验证”
问:产品小改也要重做临床吗?
答:不一定。如果变更落在《免于临床评价目录》范围内,可用同品种比对替代;否则,优先走临床前动物试验+台架测试,节省时间和费用。
Step 3 供应链合规双保险
- 与关键原料供应商签订质量协议,明确变更通知期≥90天
- 建立来料快检实验室,对每批物料做红外光谱+热分析双重确认
Step 4 用数字化工具固化流程
问:纸质记录为什么越来越容易被开缺陷项?
答:因为无法追溯修改痕迹。上线电子批生产记录(EBR)后,任何字段修改都会自动生成审计追踪日志,满足ALCOA+原则。

Step 5 临床阶段的风险预演
| 风险点 | 预演动作 | 触发阈值 |
|---|---|---|
| 入组速度过快 | 启动源数据核查 | 单中心日入组>3例 |
| AE发生率过低 | 抽查10%原始病历 | AE率<0.5% |
| 数据录入延迟 | 发送CRA预警邮件 | 超过48小时未录入 |
Step 6 建立“召回预演”机制
问:没有发生不良事件也要做召回演练吗?
答:是的。主动召回演练可以测试通知链、物流链、公众沟通链的响应速度。建议每18个月做一次,把召回完成率≥95%设为KPI。
Step 7 财务视角的风险准备金
问:合规风险到底要准备多少钱?
答:按年销售额的1.5%~3%计提风险准备金,其中50%用于法规事务、30%用于质量改进、20%用于危机公关。这笔钱单独建账,董事会每半年审计一次。
常见误区与破解方案
误区一:把ISO 13485当成“免死金牌”
ISO 13485只是质量管理体系,并不能覆盖注册法规、临床试验、上市后监测的全部要求。破解方法:在质量手册里单独设立法规符合性章节,把NMPA最新指导原则直接引用为受控文件。
误区二:忽视“使用场景”风险
问:产品在医院用得好好的,为什么到基层诊所就出问题?
答:因为使用环境、人员培训、维护能力差异巨大。破解方法:在说明书里加入分级使用建议,并配套线上培训平台,用户完成考核后才能激活保修条款。
误区三:把UDI当成一次性任务
UDI不是贴个码就结束,而是全生命周期追溯系统。破解方法:把UDI数据库与ERP、WMS、CRM打通,实现生产批次-经销商-终端用户一键追溯。
未来三年值得关注的三大变量
- AI辅助审评:国家器审中心已试点AI形式审查,格式错误将自动退回,企业需提前用AI工具自检。
- 真实世界证据(RWE):对高风险植入类产品,RWE可能替代部分临床试验,但前提是数据质量达到FDA 21 CFR Part 11标准。
- 跨境数据合规:如果服务器设在境外,必须符合《个人信息出境标准合同》,否则面临下架风险。

评论列表