多肽合成到底在解决哪些临床痛点?
多肽合成前景怎么样?一句话:它正成为继小分子与单抗之后的第三极药物形态。传统小分子靶向范围有限,大分子抗体又难以穿透细胞膜;而**长度在5-50个氨基酸的多肽**兼具两者优点,既能精准结合受体,又具备较好组织穿透力。过去十年,FDA批准的多肽药物数量年均增长率达到12%,远高于小分子药物的4%。
(图片来源网络,侵删)
技术迭代:从固相到流动相,合成效率如何飞跃?
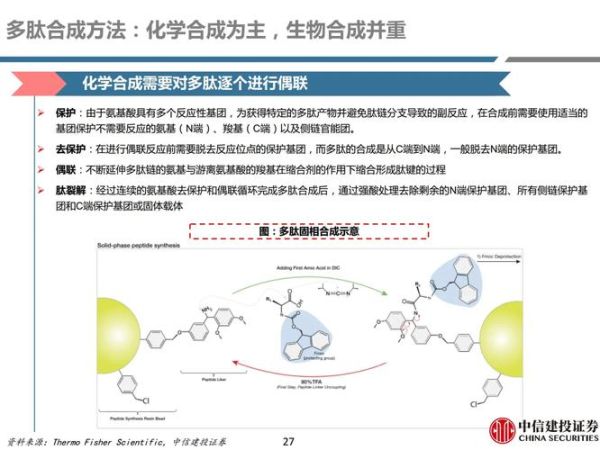
固相合成仍是主流,但瓶颈明显
- **合成通量低**:一次反应只能获得毫克级产物,放大生产需重复数百次。
- **杂质谱复杂**:缺失肽、消旋肽、氧化肽等副产物导致纯化成本占生产总成本50%以上。
流动相合成为何被寄予厚望?
流动相合成把树脂填充到微反应器中,试剂以连续流方式通过,**反应时间从小时级缩短到分钟级**。德国Bachem最新数据显示,利用连续流技术合成司美格鲁肽主链,**粗品纯度由68%提升至92%**,溶剂消耗下降70%。
市场容量:哪些适应症将贡献最大增量?
根据Nature Reviews Drug Discovery的预测,到2029年全球多肽药物市场规模将突破**700亿美元**,其中三大赛道最为抢眼:
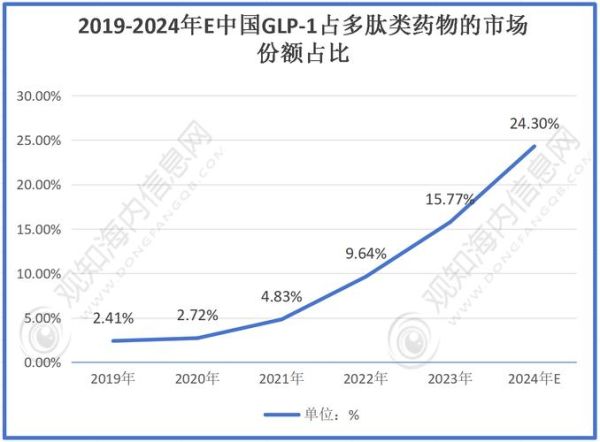
- 代谢疾病:GLP-1类多肽(如司美格鲁肽)2023年全球销售额已超200亿美元,减重适应症拓展至非糖尿病肥胖人群,未来五年复合增速预计25%。
- 肿瘤免疫:PD-1/PD-L1拮抗肽、STING激动肽进入临床Ⅱ期,**多肽偶联药物(PDC)**有望替代部分ADC,降低脱靶毒性。
- 抗感染:针对耐药菌的抗菌肽(如Pexiganan)已完成Ⅲ期,**多肽疫苗**在新冠、带状疱疹领域展现快速迭代优势。
成本曲线:原料、设备、人力哪一块下降最快?
多肽合成成本构成中,**保护氨基酸占比45%、纯化填料占比25%、人工与设备折旧占比30%**。未来五年,三大因素将推动成本下降:
- 国产保护氨基酸崛起:国内厂商如昂博生物已将Fmoc-Arg(Pbf)-OH价格拉低至每克3美元,仅为进口品牌的60%。
- 高通量纯化系统普及:自动化反相制备柱(如Waters ACQUITY Arc)单次可处理10克级粗品,纯化周期从3天压缩到8小时。
- AI辅助序列优化:通过机器学习预测易降解位点,**提前规避易氧化Met、易消旋Cys**,减少试错批次。
监管风向:FDA与EMA如何加速多肽审批?
2023年FDA发布《Peptide Drug Products Guidance》,明确**“QbD(质量源于设计)”**在多肽工艺验证中的核心地位,允许企业用连续制造数据替代传统三批验证。EMA则推出“PRIME”计划,针对罕见病多肽药物给予**早期科学建议+滚动审评**,平均审批时间缩短8个月。
投资地图:产业链哪些环节最具爆发力?
| 环节 | 代表公司 | 未来五年CAGR | 核心壁垒 |
|---|---|---|---|
| CDMO | 药明康德、凯莱英 | 28% | 连续流工艺know-how |
| 原料 | 昂博生物、吉尔生化 | 22% | 高纯度保护氨基酸产能 |
| 设备 | 赛谱科技、博纳艾杰尔 | 30% | 国产化替代+软件算法 |
风险预警:多肽合成还有哪些“暗礁”?
尽管前景乐观,但行业仍需警惕:
(图片来源网络,侵删)
- 口服生物利用度低:目前仅司美格鲁肽通过脂肪酸链修饰实现口服,其余多肽仍需注射,患者依从性受限。
- 专利悬崖临近:利拉鲁肽、度拉糖肽等核心专利2026年起陆续到期,仿制药冲击可能导致价格战。
- 环保压力增大:传统固相合成使用大量DMF、NMP等溶剂,欧盟REACH法规已限制其残留量。
未来五年,企业如何卡位?
想抓住多肽合成红利,必须回答三个问题:
- 技术路线:是否布局连续流+酶催化组合工艺?
- 适应症选择:能否避开GLP-1红海,切入NASH、阿尔茨海默病等未满足需求?
- 国际化能力:是否具备同时满足FDA cGMP与EMA GMP的双认证体系?
答案将决定谁能成为下一个“多肽界的基因泰克”。

(图片来源网络,侵删)

评论列表