一、为什么技术环境成为医药行业的“生死线”?
过去十年,全球医药市场从“专利红利”转向“技术红利”。技术迭代速度直接决定企业估值,而非传统销售规模。FDA数据显示,2023年获批新药中,67%依赖AI辅助发现,这一比例在2018年仅为12%。
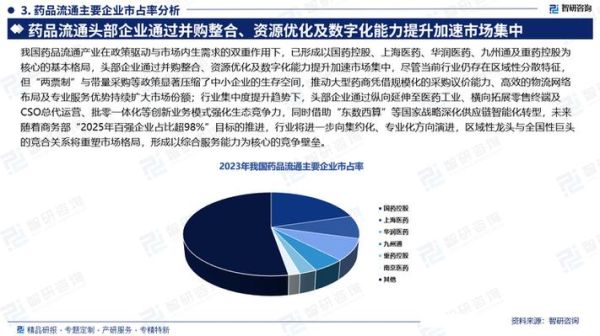
二、颠覆性技术全景扫描:谁在改写游戏规则?
1. AI药物发现:从“大海捞针”到“精准制导”
传统药物研发平均耗时12年、成本26亿美元。DeepMind的AlphaFold3将蛋白质结构预测时间从数月压缩至分钟级。国内企业如晶泰科技通过AI分子生成平台,将候选化合物发现效率提升300%。
2. 基因编辑2.0:CRISPR-Cas9之后的新战场
- 碱基编辑技术(Base Editing):无需切断DNA双链即可修正单个碱基,降低脱靶风险
- 表观遗传编辑:通过甲基化修饰调控基因表达,为癌症治疗提供“开关式”方案
- 体内递送系统:脂质纳米颗粒(LNP)的肝脏靶向效率已突破90%,但脑、肌肉递送仍是瓶颈
3. 数字孪生:临床试验的“平行宇宙”
西门子医疗的数字孪生心脏模型,可在虚拟环境中测试药物对心律失常的影响,使Ⅰ期临床试验志愿者数量减少40%。FDA已批准首个完全基于数字孪生数据的医疗器械申请。
三、技术落地的“三重门”:监管、成本、伦理
监管沙盒:如何平衡创新与风险?
中国NMPA的《人工智能医疗器械注册审查指导原则》要求AI算法必须提供可解释性报告,但欧盟AI法案对“高风险医疗AI”的界定更严苛。企业面临双重合规成本。
成本悖论:技术越先进,商业化越难?
CAR-T疗法定价高达47.5万美元/疗程,而CRISPR基因编辑疗法Casgevy定价220万美元。支付方正在探索基于疗效的分期付款模式。
伦理红线:基因增强的“潘多拉魔盒”
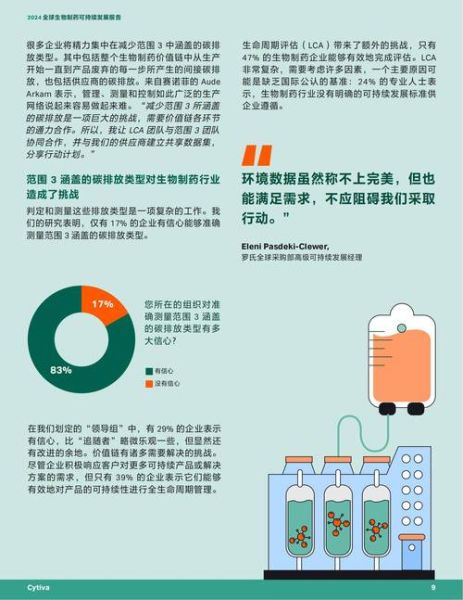
2023年《自然》调查显示,89%的遗传学家反对非治疗性基因增强。但黑市已出现“胚胎智力提升”服务,价格15万美元起。
四、未来五年技术融合路线图
2025:AI+量子计算突破蛋白质折叠极限
IBM量子处理器已模拟127量子比特的抗生素耐药蛋白,预计2025年实现1000量子比特商用,可破解传统超算需10^15年才能解决的分子相互作用问题。
2027:生物机器人完成体内药物递送
哈佛大学开发的DNA折纸机器人可在血管中自主导航,2027年有望实现肿瘤靶向给药,副作用降低80%。
2030:脑机接口药物释放系统
Neuralink的植入式芯片已能通过神经信号触发胰岛素释放,未来或实现帕金森病药物的毫秒级精准调控。
五、企业应对策略:从技术采纳到生态占位
技术雷达图:如何识别伪需求?
建立技术成熟度-临床价值矩阵:横轴为技术就绪度(TRL),纵轴为未满足医疗需求程度。只有落在右上象限的技术值得投入。
专利陷阱:CRISPR的世纪诉讼启示
张锋与杜德纳的专利战持续10年,导致全球基因编辑专利许可费上涨600%。企业需提前布局防御性专利池。

人才战争:跨界团队的组建密码
顶级AI制药团队需要“三三制”:1/3计算化学家、1/3临床医生、1/3云计算工程师。2023年全球该领域人才缺口达12万。
六、投资者视角:技术估值的新范式
传统DCF模型已失效,头部基金采用技术期权定价法:将每个在研技术视为看涨期权,其价值=技术突破概率×潜在市场规模×专利保护强度。Moderna的mRNA平台估值中,技术期权占比73%。
```

评论列表